两千亿孤儿药市场,谁主沉浮?
近年来,孤儿药市场热度升温,2024年市场规模将达2420亿美元。国内药企已经意识到孤儿药市场价值,并将其作为进入国际市场的敲门砖。
一.全球孤儿药市场热度升温
孤儿药是预防、诊断、治疗罕见病的药物。目前全球约有5000-8000种罕见疾病,3.5亿罕见病人群,我国有近2000万的罕见病患者。2018年,全球罕见病市场规模为1310亿美元,据医药市场调研机构Evaluate Pharma预测,到2024年市场规模将达2420亿美元,占全球处方药销售额的五分之一。
近年,孤儿药市场热度升温,尤其是在全球市场具有独占性的创新药独角兽备受资本青睐。2018年5月诺华宣布87亿美元收购基因治疗公司Aves,获得一款脊髓型肌肉萎缩症孤儿药;2019年3月百健为获得一系列眼科领域在研孤儿药,不惜8亿美元并购基因疗法公司Nightstar;同年5月辉瑞8.1亿美元收购罕见病临床公司Therachon,欲开发侏儒症创新疗法……国际巨头们纷纷发力孤儿药领域。
2018年营收TOP3孤儿药公司
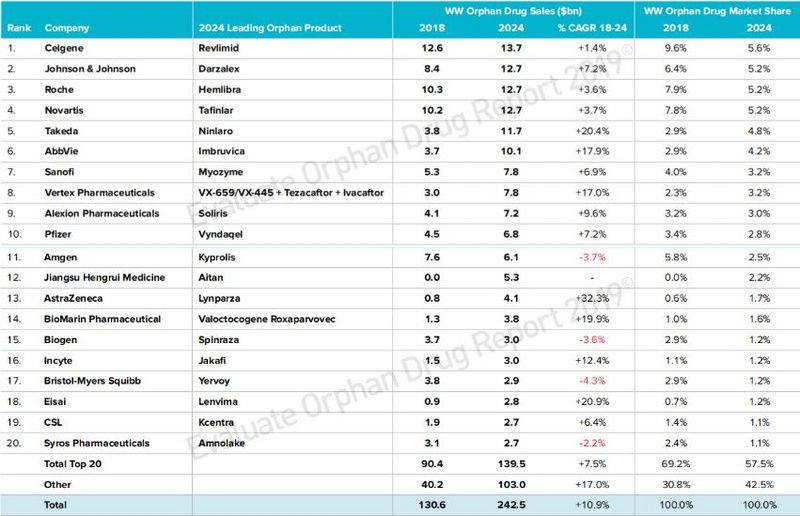
据Evaluate Pharma发布的《2019年孤儿药报告》显示,2018年孤儿药销售额排名前三的公司分别是:新基制药(126亿美元)、罗氏(103亿美元)和诺华(102亿美元),并预测2024年这三家公司将共同创造近400亿美元的收入,占孤儿药市场总额的17%。
2024年全球TOP20孤儿药公司排行
TOP 1新基——孤儿药市场领军者
2024年,专攻罕见病的新基将以137亿美元的收入继续卫冕孤儿药领域。其重磅产品多发性骨髓瘤药物Pomalyst和Revlimid将贡献超120亿美元的收入。
Revlimid是新基严重依赖的明星产品,具有抗血管生成和抗肿瘤特性,2018年,该药物创下96.85亿美元的销售额,占新基制药全年营收的63.4%。据悉,Revlimid部分专利要到2027年才到期,2022年以前该药物的市场份额并不会被撼动。此外,2019年新基为保护Revlimid在一线疗法的强势地位,多次提升药品单价,既便引来多方不满,但华尔街分析师预测该药物销售额仍将继续保持两位数的增长率。
新基第二款畅销药物Pomalyst2018年销售额为20.4亿美元,同比上涨26.4%。依靠这两款当家花旦,新基制药连续三年保持高速增长。但在未来几年,该公司必须提升营收的多元化,尤其是摆脱对Revlimid的依赖。如果在仿制药大举进军市场之前,还没有找到有效替代产品,新基有可能面临营收下滑的风险。
不过,对于被百时美施贵宝斥资740亿美元收购的新基而言,这一切都多虑了。该公司拥有非常丰富的研发管线,其炎症、血液肿瘤领域的在研产品上市后峰值将达200亿美元。值得一提的是,新基将有5种新药在2020年获得批准,其中细胞疗法liso-cel在治疗复发或难治性非霍奇金淋巴瘤已经在临床实验中显示较好的疗效和安全性,成为业界公认的潜力孤儿药。
2018年,罗氏在孤儿药领域营收103亿美元,占全年总营收的18%。2024年罗氏仍将坐拥两款营收超20亿美元的孤儿药产品,在血液孤儿药领域占据绝对优势。
血液肿瘤孤儿药Rituxan是罗氏的重磅炸弹之一,2018年该药物创造了67.5亿美元的营收,占罗氏全年销售收入的12%。但目前Rituxan正在面临专利悬崖危机。2018年11月由全球仿制药巨头Teva制药研发的仿制药Truxima获FDA批准上市;2019年2月,由复宏汉霖研制的利妥昔单抗注射液也在中国获批上市。此外,辉瑞、安进也在开发Rituxan仿制药。
面临仿制药的四面楚歌,罗氏不得不从新药中寻找增长点。Hemlibra在2017年获批治疗血友病,是唯一的血友病A以及VIII因子缺失患者的预防性疗法,并且可皮下注射,一经上市便成为罗氏的新生力量,有望改变血友病的市场格局。2024年,Hemlibra将创造34亿美元的销售总额。此外,脊髓性肌萎缩症药物Risdiplam、三阴性乳腺癌 AKT抑制剂Ipatasertib和淋巴瘤药物Polatuzumab Vedotin也将为罗氏带来近10亿美元的收入。
近年来诺华进行了业务调整,重金押注孤儿药领域。2018年,孤儿药业务收入102亿美元,占全年总营收的20%。多款明星孤儿药产品销售额突破10亿美元,骨髓纤维化药物Jakafi(23.6亿美元),白血病药物Tasigna(18.7亿美元),肺癌药物Tafinlar(11.6亿美元)均是各自领域的佼佼者。
除了已上市产品,即将上市的Zolgensma也是备受期待的孤儿药。去年5月,诺华87亿美元收购Aves获得了脊髓型肌肉萎缩症孤儿药Zolgensma。该药已获得FDA突破性疗法称号和优先审查资格,预计今年上半年将获批上市,上市后Zolgensma将成为诺华的重要业绩增长点,预计2024年将带来16亿美元的营收。
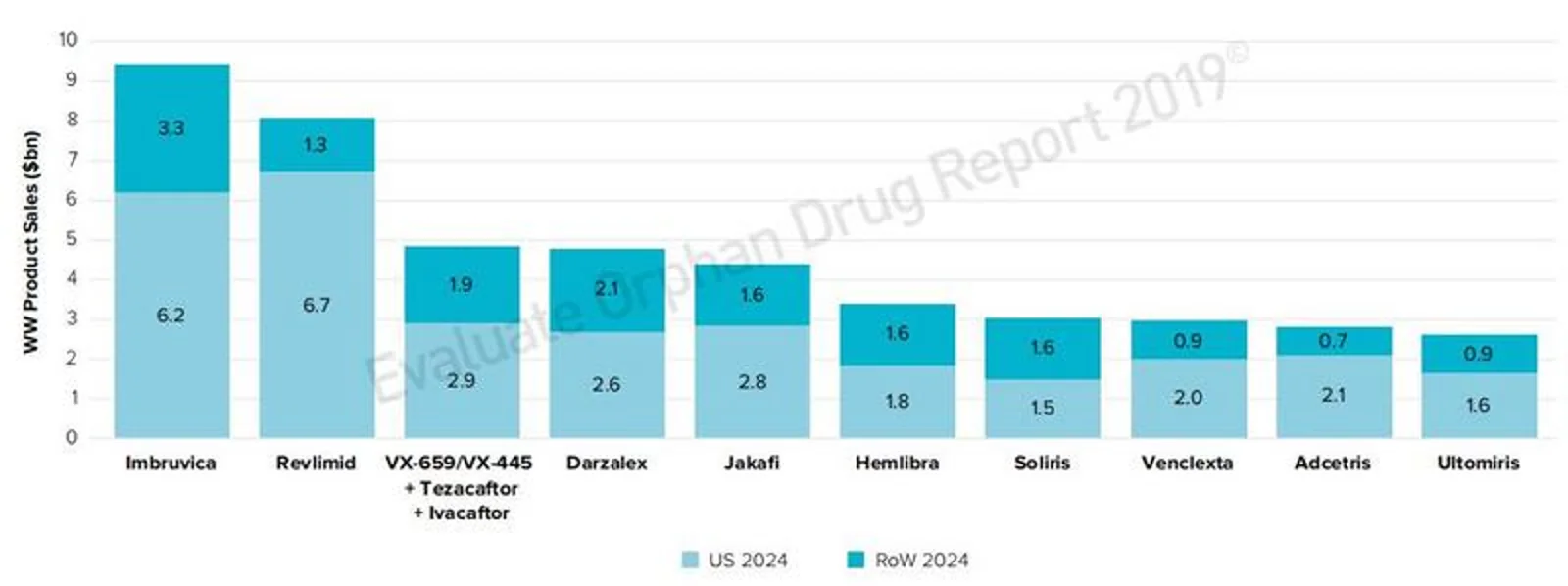
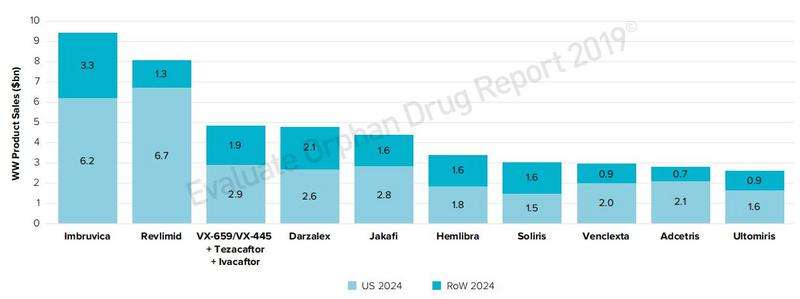
2024年全球孤儿药销售TOP 20产品
二.中国市场的三剑客
截至2018年底,我国仅有约200款孤儿药上市,不足美国的三分之一,其中仅有16款国内企业自主研发的新药拿到了20项FDA孤儿药资格认定。相较于国际市场,我国孤儿药市场仍处在边缘境地,但随着孤儿药市场规模不断扩增,国内药企已经意识到该领域市场价值,并将其作为进入国际市场的敲门砖。例如江苏恒瑞、百济神州、石药集团等企业。
江苏恒瑞
江苏恒瑞的王牌孤儿药是Aitan,由恒瑞自主研发并于2014年10月在国内上市。Aitan用于治疗转移性胃癌,是全球第一个在晚期胃癌中被证明安全有效的口服小分子抗血管生成靶向药物。由于美国胃癌患病人数较少,国际上将转移性胃癌划分到罕见病领域,但在我国胃癌发病率极高,每年有近70万人被确诊约占全球患病人数的一半左右。尽管如此,国内转移性胃癌的靶向药物市场却是一片空白。
据恒瑞财报显示,2017年医保政策调整,Aitan被纳入医保范围,2018年该药物营收同比增长68.37%,创造17.41亿人民币的销售额,约占恒瑞2018年总销售额的10%。Evaluate Pharma预计未来五年Aitan将保持40%的营收增速,2024年将带来100亿人民币的收入,成为恒瑞的长青摇钱树。在整个孤儿药领域,恒瑞也将在2024年斩获53亿美元的收入,继续引领中国的孤儿药市场。
百济神州
百济神州自主研发的BTK抑制剂泽布替尼跻身全球top10在研孤儿药。泽布替尼用于治理套细胞淋巴瘤,是首个获FDA“突破性疗法认定”的中国抗癌新药。
百济神州高层曾表示,“目前国际上同类药只有三款,相对于竞品诺华和艾伯维的伊布替尼,泽布替尼的效果更好,国际市场对BTK抑制剂需求也会更大。”
泽布替尼目前正在全球进行广泛的临床试验,在中国的上市申请,已被纳入优先审评通道,公司计划今年或2020年初向FDA提交新药上市,预计2024年将为百济神州创造11亿美元的收入。
目前百济神州收入主要来自于瑞复美和维达莎在中国的销售,这两款药在血液科建立了较好的关系,有利于泽布替尼上市早期的市场渗透和拓展。
石药集团
石药集团的丁苯酞于2018年2月获得FDA孤儿药认证,主要用于治疗急性缺血性脑卒中,有胶囊和注射液两种剂型。丁苯酞是FDA批准的第三款肌萎缩侧索硬化症药物,相较于赛诺菲的Rilutek和田边三菱的Radicava,丁苯酞是唯一具有线粒体保护作用的脑微循环重构剂。
2017年丁苯酞纳入医保后市场渗透率不断提升,据石药集团年报显示,丁苯酞近五年销售额复合增速保持在35%的水平,2018年收入42亿人民币,约占全年营收的23%,已逐步成为石药集团的重磅药物。据了解,丁苯酞专利有效期截至2023年,为应对专利危机,石药集团加大临床投入,欲申请更多新适应症,并有望基于丁苯酞的多种衍生物开发更多新药。
截至2019年5月,石药集团已有四款新药获得FDA孤儿药认证,并将在美国享受7年市场独占权和税收及科研优惠政策,孤儿药已然成为石药集团走向国际市场的新机遇。
三.孤儿药的进阶之路
美国拥有近600多种孤儿药,是全球最成熟的孤儿药市场,这离不开优厚的政策与完善的制度。《孤儿药法案》规定,获得FDA孤儿药认定的企业享有税收减免、免申请费、研发资助、加快审批以及上市后7年的市场独占权。近几年我国加大对孤儿药的扶持力度,从政策和税收等方面鼓励药企开发孤儿药。2018年我国正式颁布了《第一批罕见病目录》,首次以官方名义公布了121种罕见性疾病,对孤儿药的研发起到必不可少的支持作用。
重销售轻研发是我国药企的通病。虽然说研发是药企赖以生存的根本,拥有几百年历史的国际药企在研发方面都下足了功夫,但国内企业并没有借鉴之意。有数据显示,全球十大药企每年研发投入占销售收入比重均不低于20%,国内药企的研发占比仅在2%左右,反而用更多的资金用来补贴销售,长此以往,市面上将更多出现me too、mebetter药物,原研药市场将依旧被外企所占领。
国外巨头很多都是利用政策优势从孤儿药进行突破,如诺华借格列卫逐步挺进血液肿瘤市场,亚力兄公司由及罕见病药物研发逐渐过渡到罕见病领域,他们在最初瞄准的都是患病人群较小的病种,上市后再扩大适应症到更广泛的治疗领域,进而获取更大的商业价值。在大病种赛道越发拥挤的压力下,我国药企可借鉴这一经验,以竞争较小的孤儿药为契机拓展国际市场。